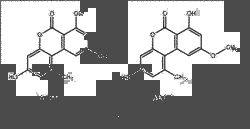
AOH und AME
Kurzzusammenfassung
Alternariol (AOH) und Alternariolmonomethylether (AME) sind die bekanntesten von Alternaria alternata gebildeten Mykotoxine. Die akute Toxizität ist relativ gering, allerdings gibt es Hinweise auf genotoxische Wirkungen. Die Gehalte in Lebensmitteln sind in der Regel niedrig, allerdings kann im Moment auf Grund der unklaren toxikologischen Datenlage ein Risiko für den Verbraucher noch nicht ausgeschlossen werden.
Struktur
Alternariol (AOH; 3,7,9-trihydroxy-1-methyl-6H-Dibenzo[b,d]pyran-6-on) und sein Monomethylether (AME; 3,7-dihydroxy-9-methoxy-1-methyl-6H-Dibenzo[b,d]pyran-6-on) sind Derivate des Dibenzopyrons. Sie kristallisieren in farblosen Nadeln und haben Schmelzpunkte von 350 °C (Zers.) (AOH) bzw. 267 °C (AME) [1].
Geschichte
Bereits im Jahre 1953 wurden AOH und AME aus einer Kultur von Alternaria tenuis* isoliert und die Struktur von AOH durch klassische organisch-chemische Strukturanalytik korrket zugeordnet [1]. Erst acht Jahre später wurde die genaue Position der Methylgruppe des AME aufgeklärt [2].
Biosynthese
AOH ist ein typisches Polyketid und wird durch die Kondensation von Malonyl-CoA und mehrern Acetyl-CoA-Einheiten durch eine Polyketidsynthase gebildet. AME wird aus AOH durch Methylierung der Hydroxygruppe an Position 9 durch S-Adenosylmethionin (SAM) synthetisiert [4].
Die Biosynthese von AOH wird besonders durch die Wasseraktivität aw des Substrats bestimmt. Insbesondere bei Alternaria-Stämmen, die von Tomaten (hoher aw-Wert) isoliert wurden, führte bereits eine geringfügige Reduzierung des aw-Werts zu einer Einstellung der Produktion an AOH, obwohl der Pilz nach außen hin normal weiter wuchs. Die Biosynthese von AOH wird von dem Schimmelpilz also nur auf einem für ihn passendem Habitat aktiviert, das eine Infektion vielversprechend erscheinen lässt [5].
Biologische Bedeutung
AOH und AME werden von Schimmelpilzen der Gattung Alternaria gebildet. Der Stamm Alternaria alternata gilt als der wichtigste Toxinbildner, allerdings können AOH oder AME u. a. auch von A. solani, A. brassicae, A. citri, A. tenuissima synthetisiert werden [6].
Nach jüngsten Untersuchungsergebnissen spielt die Bildung von AOH eine wesentlichen Rolle bei der Besiedelung und Kolonisation von Tomatenfrüchten durch Alternaria alternata. Mutanten des Schimmelpilzes, die kein AOH (und AME) bilden konnten, wuchsen deutlich schlechter auf inokulierten Tomatenfrüchten als der Wildtyp. Erst wenn AOH zustätzlich appliziert wurde, konnte auch der Mutant die Tomate in größerem Umfang infizieren [5].
Toxikologie
Akute Toxizität
Die LD50-Werte von AOH und AME wurden als >400 mg/kg KG (Mäuse, intraperitoneal) bestimmt [7]. Somit weisen beide Verbindungen eine nur geringe akute Toxizität auf.
Genotxizität
In-vitro-Studien an Zelllinien haben aufgezeigt, dass AOH und AME in der Lage sind, Strangbrüche in der DNA hervorzurufen [8]. Teilweise dürfte dies darauf zurückzuführen sein, dass AOH als Inhibitor der DNA-Topoisomerasen I und II fungieren kann [9].
Mutagenität
Im Ames-Test mit S. typhimurium zeigten AOH und AME keine bzw. eine nur geringe Mutagenität [10, 11].
Chronische Toxizität
Es liegen bisher keine wissenschafltlich unumstrittenen Belege für eine Cancerogenität von AOH und AME vor. Völlig auszuschließen ist dies jedoch nicht, da beide Verbindungen genotoxische Eigenschaften aufweisen.
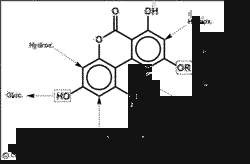
Metabolismus
In-vitro-Studien zeigten, dass AOH und AME einem ausgepägtem Metabolismus unterliegen, wenn sie mit Leber-Mikrosomen verschiedener Spezies (Ratte, Schwein, Mensch) inkubiert wurden. Neben 9-O-Demethylierung beim AME traten vor allem Produkte eines oxidativen Metabolismus durch Cytochrom P450 Enzyme (Phase-I-Reaktion) auf, d. h. Monohydroxilierung am aromatischen Kern bzw. an der 1-Methyl-Seitenkette [12]. Im selben Mikrosomen-System ließ sich auch eine Glucuronidierung durch UDP-Glucuronosyl-Transferasen beobachten, die zu 3-O- und 9-O-Glucuroniden [13] führte (Phase-II-Reaktion).
Vorkommen in Lebensmitteln
Da Schimmelpilze der Gattung Alternaria weit verbreitet sind, können die von Ihnen gebildeten Mykotoxine AOH und AME auch in einer Vielzahl von Lebensmitteln vorkommen. Dabei scheinen aber einige Lebensmittel besonders betroffen zu sein:
| Lebensmittel | Anteil positive Proben AOH | Gehalte AOH [µg/kg] | Anteil positive Proben AME | Gehalte AME [µg/kg] | ||
| Tomatenprodukte | 14/15 | 1,4 - 30 | 15/15 | 0,2 - 33 | [14] | |
| Fruchtsaft | 14/20 | 0,6 - 5,6 | 10/20 | 0,05 - 1,4 | [15] | |
| Fruchtsaft | 4/19 | 0,03 - 0,46 | 5/19 | 0,01 - 40 | [16] | |
| Fruchtsaft | 14/15 | 0,1 - 7,8 | 11/15 | 0,03 - 0,8 | [17] | |
| Wein | 23/47 | 0,03 - 19,4 | 21/47 | 0,01 - 0,2 | [16] | |
| Wein | 13/13 | 0,1 - 7,6 | 7/13 | 0,03 - 0,15 | [17] | |
| Gewürze | 10/16 | 10 - 57 | 13/16 | 5 - 11 | [18] |
Grenzwerte
Der Gesetzgeber hat noch keine Grenzwerte für AOH und AME erlassen.
Analytik
Klassischerweise wurden AOH und AME durch Hochleistungsflüssigkeitschromatographie (HPLC) mit UV-Detektion bestimmt [19-22]. Die Nachweisempflindlichkeit und Selektivität dieser Methoden war jedoch häufig nicht zufriedenstellend für die Analytik von Lebensmitteln.
Neuere Methoden verwenden HPLC mit massenspektrometrischer Detektion [15, 16], teilweise auch unter Verwendung von isotopenmarkierten internen Standards [14, 17, 18]. Die größere Empfindlichkeit und Selektivität dieser Methoden ermöglichte die Analytik von AOH und AME im Spurenbereich.
Andere Methoden wie Gaschromatographie mit massenspektrometrischer Detektion [23], Dünnschichtchromatographie [24] oder ELISA [25] sind entweder historisch oder haben sich noch nicht durchgesetzt.
Einzelnachweise
[1] Raistrick H. et al. (1953); Biochem J., 55: 421-433
[2] Thomas R. (1961) Biochem J., 80: 234-240
[3] Woudenberg J.H.C. et al. (2013) Studies in Mycology, 75: 171-212
[4] Stinson E.E. (1985) Journal of Food Protection, 48: 80-91
[5] Graf E. et al. (2012) Int. J. Food Microbiol., 157:353-359
[6] Logrieco et al. (2009) World Mycotoxin Journal, 2: 129-140
[7] Pero R.W. et al. (1973) Environ. Health Perspect., 4: 87–94
[8] Pfeiffer E. et al. (2007) Mycotoxin Research, 23: 152-157
[9] Fehr M. et al. (2009) Molecular Nutrition and Food Research, 53: 441-451
[10] Scott P.M., Stoltz D.R. (1980) Mutation Research, 78: 33-40
[11] Davis V.M., Stack M.E. (1994) Applied and Environmental Microbiology, 60, 3901-3902
[12] Pfeiffer E. et al. (2007) Molecular Nutrition and Food Research, 51: 307-316
[13] Pfeiffer E. et al. (2009) Mycotoxin Research, 25: 3-10
[14] Asam S. et al. (2011) Deutsche Lebensmittel-Rundschau, 107: 121-125
[15] Lau B.P.-Y. et al. (2003) Journal of Chromatography A, 998: 119-13
[16] Scott P.M. et al. (2006) Mycotoxin Research, 22: 142-147
[17] Asam S. et al. (2009) Journal of Agricultural and Food Chemistry, 57: 5152-5160
[18] Asam S. et al. (2012) Deutsche Lebensmittel-Rundsschau, 108: 71-73
[19] Da Motta S., Soares L.M.V. (2000) Brazilian Journal of Microbiology, 31: 315-320.
[20] Delgado T. et al. (1996) Journal of Chromatography A, 731: 109-114
[21] Solfrizzo M. et al. (2004) Journal of AOAC International, 87: 101-106
[22] Terminiello L. et al. (2006) Mycotoxin Research, 22: 236-240
[23] Scott P.M. et al. (1997) J. Chromatography A, 765: 255-263
[24] Visconti A. et al. (1986) Food Additives and Contaminants, 3: 323-330
[25] Ackermann Y. et al. (2011) Journal of Agricultural and Food Chemistry, 59: 6360-6368